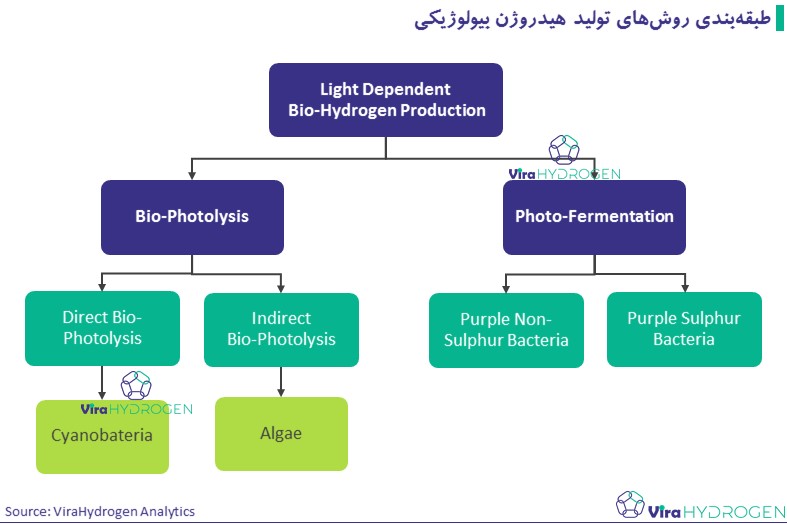
در سال ۱۹۳۹، هیدروژن بیولوژیکی برای اولین بار توسط یک محقق آلمانی مشاهده و کشف شد. هانس کافرون محقق آلمانی در دانشگاه شیکاگو، به طور اتفاقی هنگام کار در آزمایشگاه خود، مشاهده نمود که جلبکی که بر روی آن تحقیق میکند (یک جلبک سبز) برخی مواقع به جای تولید اکسیژن، هیدروژن تولید میکند. او دلیل این تغییر در فرایند تولید اکسیژن به هیدروژن توسط جلبک را هزگر متوجه نشده. در انتهای دهه 1990 تا 2000، آناستاسیوس ملیس، محقق دانشگاه کالیفرنیا، متوجه شده که اگرمحیط کشت جلبک، از گوگرد تهی سازی شود، میتواند از طریق فتوسنتز نرمال در تولید اکسیژن به تولید هیدروژن تغییر کند. در حالت کلی روشهای تولید هیدروژن بیولوژیکی به شرح زیر طبقهبندی میشوند:
(برای مطالعه مقاله “فرایند ها و منابع تولید هیدروژن” اینجا کلیک کنید)
- نورکافت زیستی مستقیم
- نورکافت زیستی غیرمستقیم
- تخمیر نوری
- تخمیر تاریک
- فرآیند دو مرحلهای (ادغام تخمیر تاریک و تخمیر نوری)
- الکترولیز با کاتالیست زیستی
طبقهبندی روشهای تولید هیدروژن بیولوژیکی نورکافت زیستی مستقیم
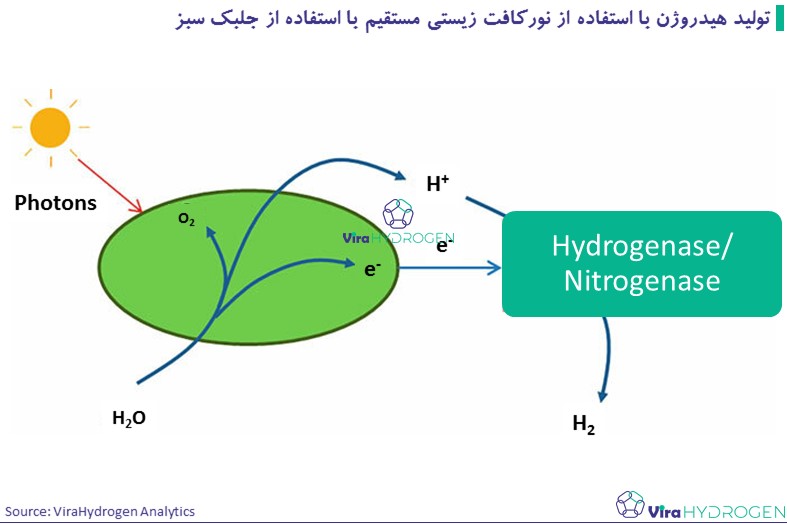
این روش مشابه فرآیندهایی است که در گیاهان و فتوسنتز جلبکها یافت میشود. در این فرآیند، انرژی خورشیدی به طور مستقیم از طریق واکنشهای فتوسنتزی به هیدروژن تبدیل میشود:
جلبکها مولکولهای آب را از طریق فتوسنتز به یون هیدروژن و اکسیژن تقسیم میکنند. یونهای هیدروژن تولید شده توسط آنزیم هیدروژناز به گاز هیدروژن تبدیل می شوند. Chlamydomonas reinhardtii یکی از جلبکهای تولید کننده هیدروژن شناخته شده است. فعالیت هیدروژناز در سایر جلبکهای سبز مانند Scenedesmus obliquus، Chlorococcum littorale، Platymonas subcordiformis و Chlorella fusca نیز مشاهده شده است.
مزیت این روش این است که خوراک اولیه آب است که ارزان است و تقریباً همه جا در دسترس است.
روش نورکافت زیستی مستقیم باید در فشار جزئی اکسیژن نزدیک به یک اتمسفر عمل کند، که هزار برابر بیشتر از حداکثر غلظت قابل تحمل آنزیم هیدروژناز است. بنابراین، حساسیت واکنش آنزیم هیدروژناز به اکسیژن از یک سو و نیاز به اکسیژن برای تداوم مسیر تولید هیدروژن مشکل مهمی است که در 30 سال گذشته موضوع تحقیقات بوده است.
تولید هیدروژن با استفاده از نورکافت زیستی مستقیم با استفاده از جلبک سبز در حال حاضر توسط سه پارامتر محدود شده است: (1) راندمان کم فرایند فتوسنتز برای تبدیل انرژی خورشیدی (ب) جداسازی هیدروژن از آب و (iii) هزینه و طراحی راکتور زیستی.
تعدادی از رویکردها برای بهبود تولید H2 توسط جلبک های سبز در حال حاضر تحت بررسی هستند. اینها شامل مهندسی ژنتیک قسمتهای جمعآوری نور، بهینهسازی ورودی نور به فوتوبیوراکتورها و بهبود سیستمهای تولید دو فازی H2 مورد استفاده با جلبکهای سبز میشود. در روش نورکافت زیستی مستقیم ، نرخ تولید هیدروژن از مرتبه 0.07 میلی مول در ساعت در لیتر گزارش شده است.
تولید هیدروژن با استفاده از نورکافت زیستی مستقیم با استفاده از جلبک سبز نورکافت زیستی غیرمستقیم
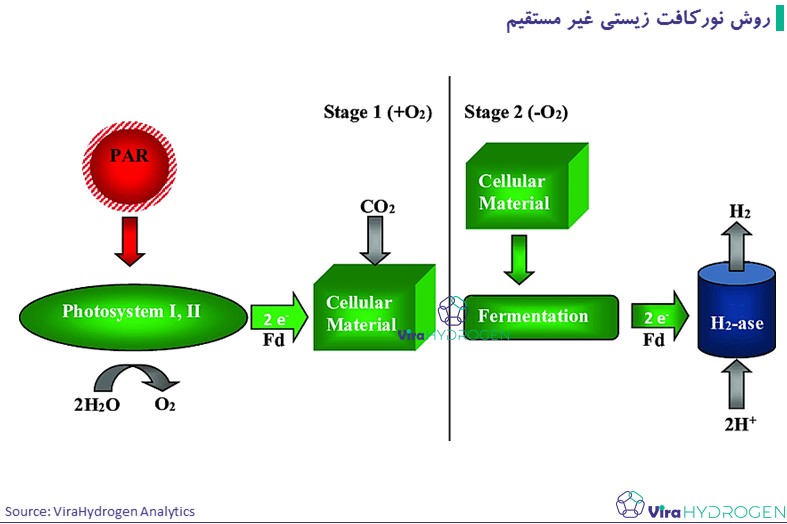
در روش نورکافت زیستی غیر مستقیم، مشکلات حساسیت فرآیند مسیر تولید هیدروژن به طور بالقوه با جداسازی زمانی و/یا مکانی مسیرهای مصرف اکسیژن و تولید هیدروژن تا اندازهایی رفع میشود. بنابراین فرآیندهای روش نورکافت زیستی غیرمستقیم شامل جداسازی مسیرهای واکنشهای تولید H2 و O2مصرف به مراحل جداگانه، همراه با تثبیت/تکامل CO2 است. واکنشها در ادامه ارایه شده است:
موجوداتی که این واکنشها را صوت میدهند سیانو باکترها هستند. سیانوباکتریها دارای ویژگیهای منحصر به فرد استفاده از CO2 در هوا به عنوان منبع کربن و انرژی خورشیدی به عنوان منبع انرژی هستند. سیانوباکتریها دارای آنزیمهای کلیدی (نیتروژناز و هیدروژناز) هستند که عملکردهای متابولیکی را برای دستیابی به تولید هیدروژن انجام میدهند. به دلیل نرخ بالاتر تولید H2 توسط گونهها و سویههای Anabaena، این گونهها مورد مطالعه زیادی قرار گرفتهاند. در بیوفوتولیز غیرمستقیم سویههای جهش یافته A. Variabilis نرخ تولید هیدروژن در حد 0.355 میلی مول در ساعت در لیتر را نشان دادند.
-
- روش نورکافت زیستی غیر مستقیم
تخمیر نوری
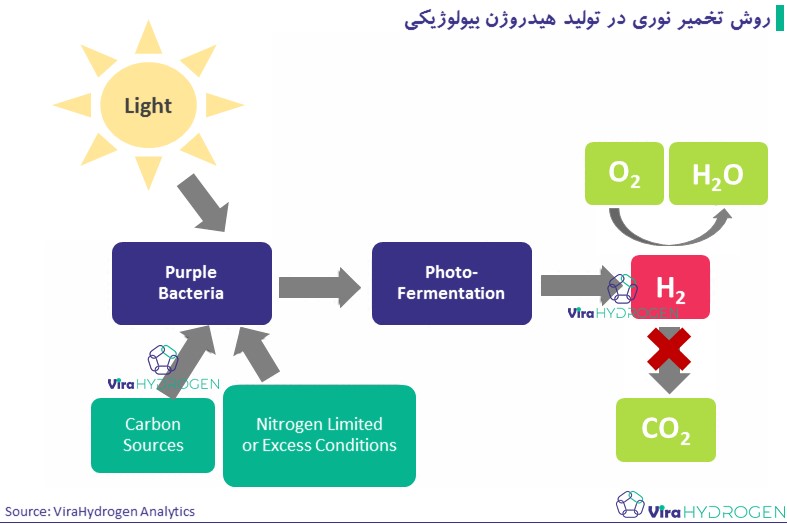
تولید H2 توسط باکتریهای غیر گوگردی بنفش عمدتاً به دلیل وجود نیتروژناز در شرایط کمبود نیتروژن با استفاده از انرژی نور و ترکیبات کاهش یافته (اسیدهای آلی) است. این واکنش به شرح زیر است
باکتریهای فتوسنتزی مدتهاست که به دلیل ظرفیت تولید مقادیر قابل توجه هیدروژن مورد مطالعه قرار گرفتهاند. مزیت این روش این است که اکسیژن مانع انجام فرآیند نمیشود. این باکتریهای فتوهتروتروف برای تبدیل انرژی نور به H2 با استفاده از ضایعات آلی به عنوان سوبسترا در فرآیندهای دستهای، کشتهای پیوسته یا سیستم سلولی کامل بیحرکت با استفاده از ماتریسهای جامد مختلف مانند carrageenan، ژل آگار، شیشه متخلخل و فوم پلی اورتان مناسب هستند.
معایب این روش دسترسی محدود به اسیدهای آلی، سرعت کم آنزیم نیتروژناز، نیاز به مقدار بالای انرژی و اکسیداسیون مجدد هیدروژن است. برای افزایش فعالیت نیتروژناز و کاهش انرژی مورد نیاز، باید نسبت مناسب کربن به مواد مغذی نیتروژن حفظ شود. یکی دیگر از عوامل اصلی موثر بر فرآیند تخمیر نوری، شدت نور است. اگرچه افزایش شدت نور اثری محرک بر نرخ کلی تولید هیدروژن توسط میکروارگانیسمهای فتوسنتزی نشان می دهد، اما میتواند اثر نامطلوبی نیز بر بازده در شدتهای نور بالا داشته باشد. با این وجود می توان با دستکاری ژنتیکی می توان میزان استفاده از نور را بهبود بخشید و در نتیجه اثر اشباع نور را کاهش داد. نرخ تولید هیدروژن در حدود 145-160 میلی مول در ساعت با این روش گزارش شده است.
روش تخمیر نوری در تولید هیدروژن بیولوژیکی تخمیر تاریک
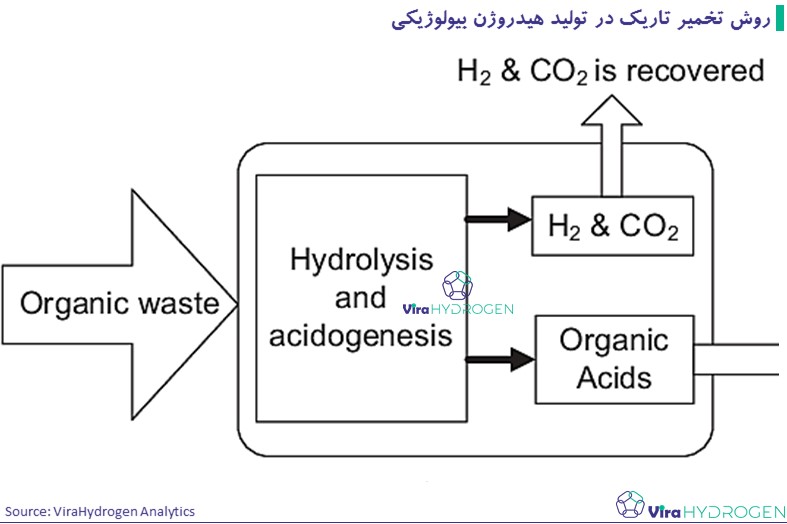
هیدروژن میتواند توسط باکتری های بی هوازی که در تاریکی روی بسترهای غنی از کربوهیدرات رشد می کنند، تولید شود. باکتری های شناخته شده برای تولید هیدروژن شامل گونههایی از انتروباکتر، باسیلوس و کلستریدیوم هستند. کربوهیدرات ها، عمدتاً گلوکز، منابع کربن ترجیحی برای فرآیندهای تخمیر هستند. از نظر تئوری تبدیل زیستی 1 مول گلوکز، 12 مول گاز هیدروژن (H2) تولید می کند.
اما این راندمان قابل دستیابی نیست زیرا مسیرهای متابولیکی تولید هیدروژن راندمان 100 ندارند، این مسیرها شامل واکنشهای رقابتی که محصولات جانبی تولید می کنند، می شود و شرایط محیطی چالش برانگیز محدود می شود. همچنین، غلظت بالای گلوکز یا هیدروژن میتواند فعالیت میکروبی را مهار کند و عملکرد را بیشتر کاهش دهد. واکنشهای واقعی عمدتاً اسیدهای استیک و بوتیریک را همراه با گاز هیدروژن ایجاد می کنند.
بر اساس استوکیومتری واکنش، تبدیل زیستی 1 مول گلوکز به استات، 4 مول هیدروژن به دست میدهد، اما زمانی که بوتیرات محصول نهایی باشد، تنها 2 مول تشکیل میشود. در حال حاضر فرآیندهای تخمیر 2.4 تا 3.2 مول هیدروژن در هر مول گلوکز تولید میکنند.
در حالی که سیستمهای نورکافت زیستی مستقیم و غیرمستقیم H2 خالص تولید میکنند، فرآیندهای تخمیر تاریک یک بیوگاز مخلوط تولید میکنند که عمدتاً حاوی H2 و دیاکسید کربن (CO2) است، اما ممکن است حاوی مقادیر کمی متان (CH4)، CO و/یا سولفید هیدروژن (H2S) نیز باشد. . تخمیر تاریک نسبت به تخمیر نوری برتری دارد زیرا به نور نیاز ندارد و انرژی تولید شده به دلیل تخمیر قند و کربوهیدرات ها نسبتاً بالاتر است. این فرآیند با هیدرولیز پلیمرهای آلی به مونومر آغاز میشود، سپس تبدیل مونومرها به اسیدهای آلی، الکلها و هیدروژن ادامه می یابد. اگرچه تولید بیوهیدروژن توسط تخمیر تاریک نسبت به تخمیر نوری امیدوارکننده و سودمند است.
-
با این حال، نیاز زیست توده آلی به عنوان ماده اولیه، این فرآیند را بسیار گران می کند. تولید هیدروژن توسط این باکتری ها به شدت به شرایط فرآیند مانند pH، زمان ماند هیدرولیک (HRT) و فشار جزئی گاز بستگی دارد که بر تعادل متابولیک تأثیر می گذارد. فشار جزئی H2 (pH2) یک عامل بسیار مهم برای سنتز پیوسته H2 است. مسیرهای سنتز هیدروژن به غلظت H2 حساس هستند و می توانند مانع تولید محصول نهایی شود. با افزایش غلظت H2، سنتز H2 کاهش می یابد. قندها و زیست توده غنی از کربوهیدرات به عنوان مناسب ترین ماده اولیه برای تشکیل بیوهیدروژن از تخمیر تاریک گزارش شده است. در آزمایشهای آزمایشگاهی، نرخهای متفاوتی برای تولید هیدروژن گزارش شده است که برای نمونه در حد 21 میلیمول بر لیتر در ساعت، 5/64 میلیمول در لیتر ساعت، 121 میلیمول در لیتر در ساعت گزارش شده است.
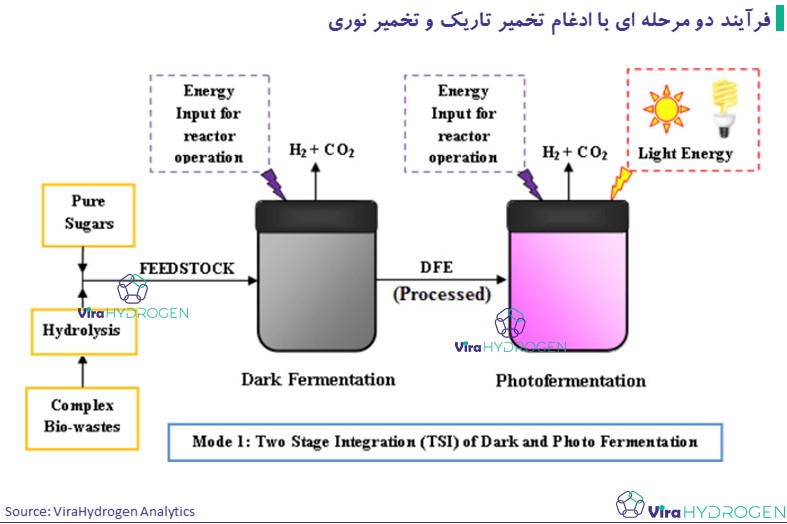
روش تخمیر تاریک در تولید هیدروژن بیولوژیکی فرآیند دو مرحله ای با ادغام تخمیر تاریک و تخمیر نوری
در تخمیر، اکسیداسیون کامل 1 مول گلوکز، 12 مول هیدروژن تولید می کند. با این حال، اکسیداسیون کامل گلوکز به هیدروژن و دی اکسید کربن امکان پذیر نیست زیرا واکنش مربوطه از نظر ترمودینامیکی امکان پذیر نیست.
با منبع انرژی خارجی (فوتون-انرژی در تخمیر نوری) از نظر تئوری می توان 12 مول هیدروژن در هر مول گلوکز تولید کرد. با این حال این فرآیند در غیاب نور قابل اجرا نیست. از سوی دیگر، در غیاب انرژی خارجی (در مورد تخمیر تاریک)، اکسیداسیون گلوکز توسط باکتری های تخمیری منجر به سایر محصولات جانبی نیز می شود و حداکثر 4 مول هیدروژن در هر مول گلوکز مصرفی با استات به عنوان تنها lمحصول جانبی تولید می شود.
استات تولید شده در مرحله تخمیر تاریک می تواند توسط باکتری های فتوسنتزی اکسید شده و هیدروژن تولید کند.
از این رو تولید مداوم هیدروژن در حداکثر بازده را می توان با ادغام روش های تاریک و تخمیر عکس به دست آورد. نرخ تولید هیدروژن به دست آمده در این روش 47.92 میلی مول در لیتر در ساعت و 51.20 میلی مول در لیتر در ساعت گزارش شده است.
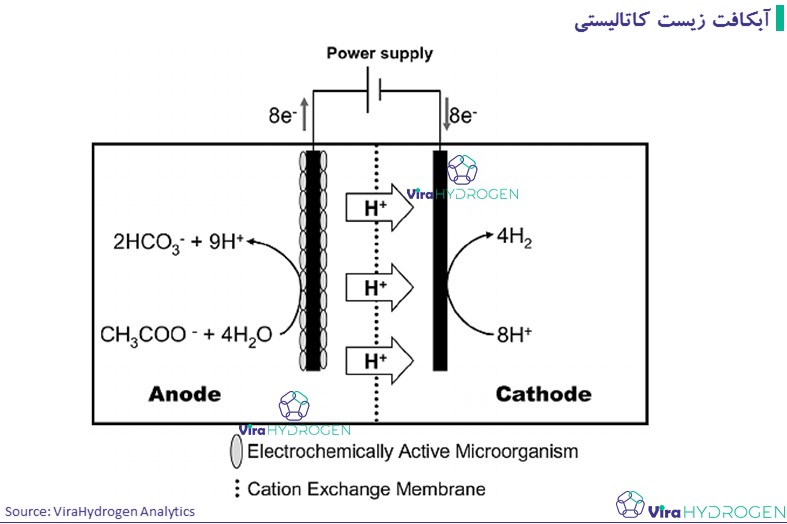
فرآیند دو مرحله ای با ادغام تخمیر تاریک و تخمیر نوری آبکافت زیست کاتالیستی
راه دیگر اکسید کردن استات (یا پساب فرآیند تخمیر تاریک) برای تولید هیدروژن، تامین انرژی خارجی به شکل انرژی الکتریکی به جای انرژی خورشیدی است.
در این رویکرد، بیوراکتور حاوی استات، محفظه آندی یک سلول الکترولایزر را تشکیل میدهد و پروتونها و الکترونهای تولید شده توسط باکتریها در کاتد (یک الکترود پلاتین که واکنش تکامل هیدروژن را کاتالیز میکند) جمعآوری میشوند. واکنش های آندی و کاتدی به شرح زیر است:
از واکنش های یاد شده، می توان نتیجه گرفت که حدود 100 میلی ولت برای تولید هیدروژن در کاتد از یک منبع خارجی مورد نیاز است. با این حال، به دلیل {اثرات گرادیان غلظتی که منجر به}پتانسیل بیش از حد در الکترودها {می شود}، ولتاژی بالاتر از 100 میلی ولت برای تولید هیدروژن مورد نیاز است. در این روش، بازده 73% هیدروژن در هر مول استات برای ولتاژ250 میلی ولت و بازده 53 ± 3.5% با استات در منبع خارجی 500 میلی ولت بدست آمد.
آبکافت زیست کاتالیستی مقایسه روشهای مختلف تولید زیستی هیدروژن
معایب مزایا فرآیند · نیاز به شدت نور زیاد O2 می تواند برای سیستم خطرناک باشد · راندمان فتوشیمیایی پایین تر
· می تواند H2 را مستقیماً از آب و نور خورشید تولید کند · انرژی تبدیل خورشیدی نسبت به درختان و گیاهان ده برابر افزایش یافته است.
نورکافت زیستی مستقیم · آنزیم های هیدروژناز جذبی باید حذف شوند تا تخریب H2 متوقف شود · حدود 30 درصد O2 در مخلوط گاز وجود دارد
· قابلیت تثبیت N2 از اتمسفر را دارد · سیانوباکتری ها می توانند H2 را از آب تولید کنند
نورکافت زیستی غیرمستقیم · O2 اثر مهاری بر نیتروژناز دارد · راندمان تبدیل نور بسیار کم است، فقط 1-5٪
· این باکتری ها می توانند از انرژی نوری طیف گسترده ای استفاده کنند · می تواند از زباله های آلی مختلف استفاده کند
تخمیر نوری · O2 یک مهار کننده قوی هیدروژناز است · بازده نسبتاً کمتر قابل دستیابی هیدروژن
· با افزایش بازده، تخمیر H2 از نظر ترمودینامیکی نامطلوب می شود
· مخلوط گاز محصول حاوی CO2 است که باید جدا شود
· می تواند در تمام طول روز بدون نور H2 تولید کند · انواع منابع کربن را می توان به عنوان بستر استفاده کرد
· متابولیت های ارزشمندی مانند اسیدهای بوتیریک، لاکتیک و استیک را به عنوان محصولات جانبی تولید می کند
· این فرآیند بی هوازی است، بنابراین مشکل محدودیت O2 وجود ندارد
تخمیر تاریک مقایسه بزرگی مقدار هیدروژن تولیدی
بزرگی مقدار هیدروژن تولیدی (میلی مول بر لیتر بر ساعت) فرآیند 0.07 نورکافت زیستی مستقیم 0.355 نورکافت زیستی غیرمستقیم 145-160 تخمیر نوری 2-121 تخمیر تاریک 40-60 فرآیند دو مرحله ای با ادغام تخمیر تاریک و تخمیر نوری